Методическое письмо МЗ Украины
Министерство здравоохранения Украины
Национальная Академия медицинских наук Украины
Украинский центр научно-медицинской информации и патентно-лицензионной работы
Согласовано
Начальник лечебно-организационного Управления НАМН Украины
член-корр. НАМН Украины
_______________ В.В. Лазоришинец
«____» ______________ 2011 р.
Согласовано
Директор Департамента охраны материнства, детства и санаторного обеспечения МЗ Украины
_________________ С.И. Осташко
«______» ______________ 2011 р.
ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ
ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСЕ ИММУНОРЕАБИЛИТАЦИОННЫХ МЕРОПРИЯТИЙ
(методические рекомендации)
Киев – 2011
Учреждение разработчик: ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины»
Авторы:
Антипкин Юрий Геннадиевич, (044) 483-80-67
академик НАМН Украины, д-р. мед. наук, профессор
Лапшин Владимир Федорович, (044) 483-90-85
д-р. мед. наук, профессор
Дранник Георгий Николаевич, (044) 486-54-03
д-р. мед. наук, професор
Подольский Василий Васильевич, (044) 483-80-67
д-р. мед. наук, професор
Уманец Татьяна Рудольфовна, (044) 489-10-56
канд. мед. наук
Подольский Владимир Васильович, (044) 484-40-64
врач акушер-гинеколог
Марушко Юрий Владимирович, (044) 275-33-56
д-р. мед. наук, професор
Рецензент:
Главный научный сотрудник лаборатории иммунологии ГУ «Национальный институт пульмонологии и фтизиатрии НАМН Украины», член-корр. НАМН Украины, д-р. мед. наук, профессор Чернушенко Е. Ф.
Зам. председателя проблемной комиссии МЗ и НАМН Украины
по специальности «педиатрия»: д-р. мед. наук, профессор Л.И. Омельченко
Председатель проблемной комиссии МЗ и НАМН Украины по специальности «акушерство и гинекология»: академик НАМН Украины, д-р мед. наук, профессор В.Н. Запорожан
СОДЕРЖАНИЕ
Список сокращений 4
Вступление 5
1. Медико-биологическое обоснование применения Трансфер Факторов в комплексе иммунореабилитационных мероприятий …
8
1.1 Создание лейкоцитарных антиген-специфических трансфер факторов ……………………………………………………..……….
12
1.2 Создание трансфер факторов как нутрицевтиков ……………… 20
2. Применение Трансфер Факторов при респираторных заболеваниях у детей …………………………………………………
21
2.1 Трансфер Фактор в комплексе реабилитационных мероприятий детей, которые часто болеют повторними острыми респираторными заболеваниями …………………………………….
21
2.2 Эффективность применения Трансфер Факторов при рецидивирующем бронхите …………………………………………
24
3. Эффективность Трансфер Факторов в комплексе иммунореабилитационных мероприятий у детей с бронхиальной астмой …………………………………………………………………
29
4. Эффективность применение Трансфер Фактора у детей с атопическим дерматитом ……………………………………………
32
5. Эффективность применения препаратов Трансфер Факторов в комплексной терапии у женщин с хроническими воспалительными заболеваниями половых органов ………………
34
6. Схемы применения Трансфер Факторов в комплексе иммунореабилитационных мероприятий у детей …………………
42
Выводы ………………………………………………………………. 46
Список рекомендованной литературы ……………………………… 47
СПИСОК СОКРАЩЕНИЙ
ТФ – трансфер фактор
ОРЗ – острые респираторные заболевания
РБТЛ – реакции бласттрансформации лимфоцитов
ФГА – фитогемаглютинин
ЧБД – часто болеющие дети
ДДУ – детские дошкольные учреждения
РБ – рецидивирующий бронхит
СИТ – специфическая иммунотерапия
ИГКС – ингаляционные глюкокортикостероиды
DLE – диализированный лейкоцитарный экстракт
ВСТУПЛЕНИЕ
По данным Всемирной организации здравоохранения (ВОЗ) распространенность иммунодефицитов и аллергических заболеваний продолжает увеличиваться во всем мире. Количество больных с выявленными первичными генетически детерминированными иммунодефицитами составляет около 1 % населения, приобретенными – до 20 %; от 30 до 38 % населения Украины имеет нарушения иммунной системы. Прогнозируется, что в 2015 году 40 % взрослого населения Европы будут страдать аллергией.
Разработка и внедрение в практическую медицину современных клинико-диагностических методов оценки функционирования системы иммунного гомеостаза организма, бурный рост объема данных о ведущей роли иммунной системы в патогенезе возникновения и развития многих острых и хронических заболеваний обосновывают необходимость разработки новых средств и методов, способствующих восстановлению иммунных нарушений. Появилось новое направление современной медицины – иммунореабилитация, учитывающая взаимосвязь между иммунной и другими системами (нервной, эндокринной, дыхательной, кровообращения) организма. В это понятие вкладывается не только восстановление нарушенных звеньев иммуннной системы, но и выздоровление больного при остром течении заболевания или достижения стойкой ремиссии при хронической патологии.
В настоящее время среди большого количества иммунореабилитационных мероприятий (как медикаментозних, так и немедикаментозных) широко применяются иммуномодуляторы различных видов, влияющие на отдельные звенья иммунитета. К ним относятся бактериальные препараты, препараты тимуса, костного мозга, синтезированные аналоги естественных иммуномодуляторов и биологически активних субстанций (рекомбинантные интерфероны, индукторы интерфероногенеза и др.).
В этой связи особо актуальной является разработка иммунореабилитационных комплексов с учетом патогенетических особенностей, активности заболевания, степени функциональных осложнений. При этом очень важно учитывать, чтобы разработанный и применяемый иммунореабилитационный комплекс не превышал адаптационные возможности организма, особенно у детей.
В настоящее время установлено, что на функционирование иммунной системы большую роль оказывает нерациональное питание. По данным ВОЗ рациональное питание – самая распространенная причина иммунной недостаточности среди взрослого населения и детей.
В условиях экономической и экологической нестабильности, при наличии соматической патологии, создается патологический порочный круг, при котором рецидивирующее течение заболевания нарушает функциональное состояние организма, в том числе иммунной системы, приводит к метаболическим и обменным нарушениям в организме.
Доказана способность ряда нутриентов существенно влиять на состояние иммунной системы организма, что легло в основу нового направления в нутриционной поддержке иммуномодуляции, которое получило название «immunonutrition», или «иммунное питание».
Одним из таких продуктов являются так называемые эндогенные иммуномодуляторы. К таким природным иммуномодуляторам (нутрицевтикам) относятся Трансфер Факторы, которые производятся компанией «4Life Research» (США).
Благодаря современным биотехнологиям производства, они полностью очищены от казеина, лактоглобулинов и других естественных белковых молекул и содержат цитокинные фракции, идентичные лейкоцитарным цитокинам.
За последние 10 лет проведенные клинические исследования в различных клиниках России, Украины и Казахстана показали высокую клиникоиммунологическую эффективность применения Трансфер Факторов в комплексе иммунореабилитации больных, нуждающихся в иммунокоррекции, а главное, в качестве профилактики возникновения иммунных нарушений организма у здорових людей.
Как отмечал академик РАМН А.А.Воробьев, достоинство ТФ перед другими иммуномодуляторами в том, что они обладают широким спектром действия, абсолютно безопасны и безвредны, применяются перорально,
не имеют противопоказаний к применению, не вызывают побочных действий, что особенно важно для детей.
Опыт применения ТФ в Украине, в Государственном учреждении «Інститут педиатрии, акушерства и гинекологии Национальной Академии медицинских наук Украины» и на кафедрах Национального медицинского
университета им. А.А.Богомольца показал их высокую эффективность у детей с респираторной и аллергической патологией и у женщин с хроническими воспалительными заболеваниями половых органов.
В данных Методических рекомендациях анализируются результаты этих исследований и обсуждаются вопросы и перспективы использования Трансфер Факторов в педиатрической практике (у здоровых детей и с аллергической и респираторной патологией) и у женщин с воспалительными заболеваниями половых органов. Предлагаются схемы иммунореабилитации при данных патологических состояниях.
Методические рекомендации разработаны согласно фрагментов Научно- исследовательской работы Государственного учреждения «Інститут педиатрии, акушерства и гинекологии Национальной Академии медицинских наук Украины»: «Разработка дифференцированных комплексов специфической и неспецифической иммунотерапии бронхиальной астмы у детей» (№ госрегистрации 01.U000057); «Проведение научного исследования относительно внедрения современных медицинских технологий с доказанной эффективностью в сфере репродуктивного здоровья и их медико-социального воздействия» (№ госрегистрации 01.08 U000772); «Исследование состояния репродуктивного здоровья женщин, которые перенесли хронические воспалительные заболевания половых органов и риски развития у них перинатальных нарушений (№ госрегистрации 01.11 U002055) .
Методические рекомендации предназначаются для врачей общей практики – семейной медицины, педиатров, пульмонологов, аллергологов, гинекологов, и издаются впервые в Украине на украинском и русском языках.
1. МЕДИКО-БИОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСЕ ИММУНОРЕАБИЛИТАЦИОННЫХ МЕРОПРИЯТИЙ
Внедрение в клиническую практику иммунотропных препаратов открыло небывалые перспективы в борьбе с онкологическими, аутоиммунными заболеваниями, иммунодефицитными состояниями и другой иммунозависимой патологией.
Необходимо отметить, что любые новые знания, полученные в области фундаментальной иммунологии, немедленно внедряются в практическое здравоохранение, будь-то лабораторная диагностика или лечебные препараты (достаточно вспомнить разработку технологии получения моноклональных антител). К настоящему времени созданы и продолжают создаваться многочисленные иммунотропные препараты (иммуномодуляторы). Особое место среди них занимают Трансфер Факторы (от слова трансфер — перенос), эффективность которых доказана при самых различных заболеваниях. История создания трансфер-факторов (ТФ) как лечебно-профилактических средств состоит из двух направлений:
1. Создание фармпрепаратов ТФ, полученных из лейкоцитов, обладающих специфичностью к определенному антигену, и вводимых в организм реципиента с помощью инъекций (т.н. лейкоцитарные антиген-специфические трансфер факторы).
2. Создание ТФ как нутрицевтиков из молозива крупного рогатого скота и желтка кур, обладающих интегрально-регуляторным воздействием на иммунную систему, и вводимых в организм реципиента per os.
1.1 Создание лейкоцитарных антиген-специфических ТФ.
Если иммунная система обладает памятью, можно ли ее, эту память, перенести в другой организм? Исходя из этих предположений, впервые Л. Дейч в лаборатории И.И.Мечникова (1953) показал, что клеточный иммунитет (память) можно перенести от иммунизированных животных к интактным при помощи лизатов, полученных из сенсибилизированных к конкретному антигену клеток крови. В дальнейшем Lawrence H.S. (1955) описал диализируемый лейкоцитарный экстракт (DLE), который был способен специфически переносить состояние гиперчувствительности замедленного типа к субстанции М стрептококка и туберкулину от иммунного донора к неиммунному реципиенту. Термин трансфер фактор (фактор переноса) впервые употребил Lawrence, который считал, что в DLE (диализированном лейкоцитарном экстракте) содержится нечто (трансфер фактор), с помощью которого можно перенести в другой организм иммунную память о конкретном антигене. В последующем им было также показано, что ТФ не обладают видовой специфичностью, а их молекулярная масса лежит в пределах 3500-10000 Da.
По данным Fudenberg H. et al. (1994) диализированный лейкоцитарный экстракт (DLE) содержит до 200 веществ (тимозин, серотонин, гистамин, брадикинин, аскорбат, простагландин, гипоксантин, никотинамид и др.). Определенная часть DLE обладает адъювантными свойствами (антиген-неспецифический иммуностимулирующий эффект). Часть DLE обладает иммуносупрессивным эффектом.
Другие авторы также обнаружили, что в составе ТФ (DLE) содержатся два антигенспецифических компонента – индукторный/хелперный и супрессорный (Holzman R.S. et al., 1983; Lawrence H.S., Borkowsky
W., 1996.; Ю.А.Гриневич и соавт., 2008).
Индукторный и супрессорный компоненты ТФ обладали способностью связываться со специфическим антигеном (Lawrence, 1983; Kirkpatrick, 1988).
По мнению H.Fudenberg, H.L.Fudenberg (1989) для любого антигена должен быть свой специфический ТФ. Это означает, что ТФ должны отличаться между собой так, как отличаются антиген-связывающие сайты гипервариабельных регионов иммуноглобулинов или антиген-распознающих рецепторов Т- и В-лимфоцитов.
D.C.Dumonde (1999) считает, что активное начало ТФ – низкомолекулярные антигенспецифические цитокины Т-клеточного происхождения. Они способны переносить антигенспецифическую иммунореактивность от иммунного донора к неиммунному реципиенту. Предположили, что ТФ, в зависимости от конкретных условий в организме конкретного реципиента, могут оказывать регуляторный эффект.
В эксперименте с помощью аффинной иммуносорбции на твердофазных специфических антигенах выделены и охарактеризованы препараты ТФ; их свойства в обобщенном виде представлены в табл. 1.
Таблица 1 – Общая характеристика ТФ (Ch. H. Kirkpatrik, 2000; А.Н.Мац и соавт., 2008).
Как видно из таблицы, ТФ обладали способностью прямо связываться с нативным антигеном, оказывая в последующем вспомогательный эффект при связывании комплекса антиген + ТФ с антителом. Крайне важно для понимания механизма действия ТФ их свойство адсорбироваться на Т-хелперах 1 типа, а также на моноцитах/макрофагах и гранулоцитах, вызывая их последующую активацию.
В настоящее время существует несколько гипотез относительно механизма действия лейкоцитарных специфических ТФ, которые дополняют друг друга.
Механизмы, с помощью которых действуют специфические ТФ:
- Являются фрагментами антиген-распознающих рецепторов (H.Fudenberg, 1993);
- Усиливают экспрессию рецептора ИЛ-2 (Gotlieb A.A., 1991);
- Повышают продукцию ИНФ (Ch.H. Kirkpatrick, 1993);
- Повышают уровень Са+2 в клетке, активируя кальцинейрин (Fadeenko N.P. et al., 1999);
- Связываются с мембраной лимфоцитов, делая их пассивно АГ-специфическими (Ch.H. Kirkpatrick, 1993);
- Связываются с АГ, ассистируя при его распознавании (Ch.H. Kirkpatrick, 1992);
- Являются цитокинами (или их фрагментами) Т-клеточного происхождения, участвуя в регуляции иммунного ответа (D.C.Dumonde, 1999);
- Повышают количество стволовых клеток в селезенке (V.Kofranek et al., 1989).
Говоря о том, что же представляют собой ТФ, что является их действующим началом, приведем высказывание H.Fudenberg, G.Pizza (1993), которое с нашей точки зрения полностью соответствует действительности и объясняет разносторонние механизмы действия ТФ: «Мириады пептидов, присутствующих в ТФ (DLE), соответствуют сумме иммунного опыта конкретного индивидуума. ТФ являются инструментами иммунной системы».
Многочисленные исследования доказали, что ТФ, полученные от человека или животных не обладают видовой специфичностью и обладают эффективностью при их перекрестном введении, даже от низшего вида животных высшему. Считают, что ТФ, представляя собой пептид с низкой молекулярной массой, являются теми консервативными структурами в рамках иммунной системы, которые отобрала в течение миллионов лет природа для реализации иммунных защитных реакций (J.M.Dwyer, 1996).
К настоящему времени в разных странах ТФ зарегистрированы под разными названиями в виде фармпрепаратов, полученных из лейкоцитов: «Immodin» (Чехия), «RCTF» (Япония), «Transfer Factor» (Франция,
Германия, Швейцария), «Imreg-1» и «ISS» (США), «Аффинолейкин» (Россия). Все они используются при различных патологических процессах с нарушением клеточных механизмов иммунного воспаления
(Espinosa Padilla S.E. et al., Ch.H. Kirkpatrick, 2000, 2009; Berron-Perez R. et al., 2007).
Таким образом, исследования первых 3-4 десятилетий, посвященные лейкоцитарным антигенспецифическим трансфер факторам, создали прочную научно-методическую базу для разработки пероральных
нутрицевтиков трансфер-факторов.
1.2 Создание трансфер факторов как нутрицевтиков
Переходя к ТФ нутрицевтикам напомним, что поступление пищи в организм — одно из важнейших условий для поддержания жизни.
Молозиво и желток птиц представляют собой первый пищевой продукт (нутриент), включающий в себя огромное количество инструктивных и питательных компонентов, отобранных природой за миллионы лет
эволюции (включая конкретную маму и частично папу).
В 1973 году J.A. Mohr впервые сообщил об успешном переносе (индукции) клеточной гиперчувствительности от донора к реципиенту при употреблении молозива per os и предположил, что это может быть обусловлено ТФ.
Вначале это вызвало сомнение, поскольку считали, что пептиды ТФ разрушаются в желудочно-кишечном тракте. Однако, после того, как Jeter W.S. et al (1979) показали, что трансфер фактор, введенный добровольцам per os, эффективно индуцировал у них замедленную гиперчувствительность к туберкулину и кокцидиоидину, сомнения рассеялись. В настоящее время описывают несколько механизмов, с помощью которых трансфер фактор проникает в организм и оказывает свое действие:
I. Прежде всего молекула ТФ, будучи полипептидом (44 аминокислотных остатков), расщепляется на более мелкие функционально активные пептиды (пептидолиз). Часть образовавшихся пептидов (2-3 аминокислотных остатка) проникает через межэпителиальные щели, другая часть связывается с рецепторами лимфоидных и эпителиальных клеток кишечника, захватывается отростками дендритных клеток.
II. Среди традиционных клеток эпителия тонкого кишечника есть т.н. М-клетки. Они обладают способностью к пиноцитозу и последующей транслокации захваченного в просвете кишечника материала в собственный «карман», где присутствуют клетки иммунной системы – дендритные клетки, макрофаги, распознающие доставленный материал и подающие организму соответствующий сигнал.
По мнению H.Fudenberg (1994) потенциал в лечении человеческих заболеваний ТФ, выделенными из коровьего молозива, фантастический.
Сегодня известно, что особенно молозиво, а вслед за ним и материнское молоко — это своеобразный коктейль инструктивных веществ, которые дают первый толчок и далее помогают правильно созревать иммунной системе родившегося организма. Более того, эти же вещества в первые месяцы жизни несут заместительную функцию. По данным разных авторов (R. Garofalo (2010), Brandtzaeg (2010), Lönnerdal Bo (2010)) в молозиве содержатся: sIgA; IgA, IgM, IgG; лизоцим; лактоферин; Т-лимфоциты, в основном Т-хелперы; В-лимфоциты: дендритные клетки; гормоны; цитокины (ИЛ-6, TGFβ, ИЛ-8, ИЛ-10, ГМКСФ и др.).
Суммируя, можно сказать, что сегодня к основным функциям молозива и грудного молока относятcя:
- Индукция дозревания иммунной системы и эпителиальных покровов.
- Пищевой (трофический) эффект.
- Защита от внешних и внутренних патогенов.
- Поддержание антигенного постоянства (гомеостаза) организма (интегрально-регуляторное воздействие цитокинов и их фрагментов).
В 1989 г. G.B.Wilson и G.B.Paddock запатентовали метод получения ТФ из молозива коров. Фирмой «4 Life Research» (США) были созданы с использованием указанной технологии, а также собственной патентованной технологии получения ТФ из желтков яиц птиц, были созданы и зарегистрированы в виде биологически активных пищевых добавок ТФ, получившие название Трансфер Фактор классический, Трансфер Фактор Плюс и Трансфер Фактор Эдвенсд. По данным разработчика они:
- представляют собой концентрат природных пептидов, получаемых из молозива коров или желтка яиц;
- молекулярная масса – 1000-10000 дальтон. Длина – 44 аминокислоты;
- вырабатываются клетками иммунной системы и относятся к цитокинам.
За период с 2000 по 2011 гг. в различных клиниках России, Украины и Казахстана проведены исследования, показавшие высокую клинико-иммунологическую эффективность ТФ фирмы «4 Life Research» (США) при лечении больных различными заболеваниями.
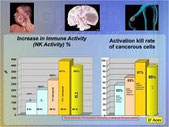
Показано, что Трансфер Фактор Плюс вызывал существенное улучшение иммунного статуса у ВИЧ-инфицированных больных (Н.В. Карбышева и соавт., 2003). Было показано, что применение Трансфер Фактор Плюс снижает резистентность к противотуберкулезным препаратам; оказывает протективный эффект при химиотерапии рака; помогает нивелировать последствия гестационного пиелонефрита; усиливает функцию естественных киллерных клеток; улучшает состояние гуморального и клеточного звена иммунитета при эрадикационной терапии H.pylori; показана более высокая эффективность при лечении псориаза и атопического дерматита (М.В.Киселевский, Е.О.Халтурина, 2003; Д.В.Киприянов, 2003; И.Г.Цой, А.М.Есенгельдиева, 2007; И.Г.Цой, Сактаганов М.И., 2007).
Согласно данных Д.В.Куприянова (2003). Доведена эффективность применения Трансфер Фактора Плюс при урогенитальным хламидиозе. Автор наблюдал две группы больных с урогенитальным хламидиозом. Одна из них получала 3 антибиотика, другая – один антибиотик в комплексе с Трансфер Фактором Плюс. Частота возникновения побочных эффектов во второй группе была намного меньше при более высокой эффективности.
В.А. Дадали и соавт. (2002) изучали эффективность применения ТФ у больных остеомиелитом в до- и послеоперационном периоде. По данным авторов ТФ, являясь иммуномодулятором, одновременно оказывал разностороннее влияние на биохимические механизмы неспецифической резистентности, включая систему свободно-радикального окисления, повышал устойчивость клеточных мембран, активность антиоксидантной защиты. Авторы считают, что ТФ обладает более широким спектром действия на организм, чем только иммунотропным, и может рассматриваться как адаптоген. Полученные данные позволяют говорить о возможности использования ТФ с целью профилактики и иммунореабилитации в группах риска и у больных с хронической бактериальной и персистирующей вирусной инфекцией.
Снижение свободно-радикального окисления липидов и повышение стабильности цитомембран оказывает протекторное действие на эпителиальный покров слизистых, увеличивая тем самым конкурентную адгезию на них физиологической микрофлоры и усиливая местный иммунитет.
Обнадеживающие результаты получены при использовании ТФ у больных псориазом и атопическим дерматитом (Головина Е.В., 2003). После назначения ТФ в комплексе с традиционной терапией уже через 7-10 дней значительно уменьшался зуд, шелушение и резко сокращалось количество высыпаний на коже; при продолжении приема препарата до 20 дней у всех пациентов наступила ремиссия.
Ищейкин К.Е. в серии работ (2008, 2008, 2009) опубликовал результаты исследования рациональной иммуномодулирующей терапии у детей, больных атопическим дерматитом, с учетом современных взглядов на патогенетические механизмы развития дерматоза. Автор делает общий вывод, что назначение комплексной терапии детям, больным атопическим дерматитом (IgE ассоциированный вариант) и детской экземой (не IgE ассоциированный вариант), в составе антигистаминного препарата эриус, иммуномодулирующего средства Трансфер Фактор классический и иммуносупрессивного средства для местного использования элидел, показало его эффективность (исчезновение субъективных ощущений и регресс клинических проявлений) и привело к увеличению клинической ремиссии на 2-3 месяца.
По данным Добровольского М.А., Тюевой Н.В. и соавт. (2008) применение Трансфер Фактора Плюс в комплексе с химиолучевой терапией распространенных форм рака шейки матки достоверно повышает темпы и степень резорбции опухоли в сравнении с традиционной лучевой терапией.
Г.Н. Дранник и соавт. (2008) изучали in vitro влияние Трансфер Фактор Эдвенсд на продукцию ИЛ-12, -15 и -18 мононуклеарными клетками периферической крови больных с частыми рецидивами герпесвирусной инфекции.
Авторы обнаружили, что Трансфер Фактор Эдвенсд обладает способностью усиливать продукцию ИЛ-12, -15, -18; считают, что это объясняет его активирующее влияние на ЕК-клетки и Т-лимфоциты, описанное в многочисленных публикациях.
По мнению авторов, Трансфер Факторы – перспективные препараты для иммунореабилитации и иммунопрофилактики. Следует отметить Информационное письмо, посвященное применению трансфер факторов для лечения и профилактики гриппа и ОРВИ (Гарник Т.П. и соавт., 2009).
Суть внедрения: возможность использования естественных иммуномодуляторов ТФ в комплексной терапии и профилактике гриппа и ГРВИ.
В.И. Донцов и В.Р. Крутько из Национального геронтологического центра Российской Федерации выдвинули свою теорию старения организма. Согласно ей вместе с организмом стареет и иммунная система, что сопровождается:
- прогрессирующей атрофией тимуса и всей лимфоидной ткани с возрастом;
- накопление с возрастом субпопуляций Т-лимфоцитов супрессоров;
- снижением количества и функциональной активности циркулирующих Т-лимфоцитов;
- снижением количества и функциональной активности естественных киллеров.
Согласно этой теории снижение функции иммунной системы приводит к развитию жизнеугрожающих заболеваний. Это подтверждается данными литературы. В настоящее время в т.н. анти-aging программах (программы предупреждения старения) ведущее место занимают иммунотропные препараты, среди которых своим потенциалом выделяются Трансфер Факторы, в особенности Трансфер Фактор Плюс.
По итогам клинических испытаний в Российской Федерации в 2004 году опубликовано Методическое письмо, в котором Трансфер факторы рекомендуется применять:
- При хронических стрессовых ситуациях.
- При переутомлении, повышенных физических нагрузках.
- В программах anti-age (профилактика старения).
- Для профилактики иммунодефицитных состояний.
- При дисрегуляции иммунных процессов.
Многочисленные экспериментальные и клинические исследования позволили суммировать иммуно-биологические эффекты Трансфер-факторов:
Биологическое действие трансфер фактора:
- модулирует функции хелперных, киллерных и регуляторных Т-лимфоцитов;
- вызывает неспецифическую активацию макрофагов;
- оказывает активизирующее влияние на ЕК-клетки (естественные киллеры);
- способствует завершенному фагоцитозу;
- способствует распознаванию антигенов макрофагами;
- ускоряет презентацию антигенов иммунокомпетентным клеткам;
- сокращает время выработки антител;
- усиливает местный иммунитет за счет снижения свободно-радикального окисления липидов и повышения стабильности цитомембран.
С учетом приведенных выше данных, а также принимая во внимание, что Трансфер Факторы для перорального применения происходят из натурального пищевого продукта, они с полным основанием могут быть отнесены к разряду нутрицевтиков, а еще более конкретно, к иммуноцевтикам, представляющим собой множественную совокупность функционально активных пептидов, происходящих прежде всего из цитокинов и оказывающих интегрально-регуляторное воздействие на клетки организма, в том числе на клетки иммунной системы. Сегодня известно, что адаптогенно-гомеостатический потенциал цитокинов обусловлен их способностью объединять в функционально-единую сеть иммунную, нервную и эндокринную системы, а также эпителиальные и эндотелиальные покровы организма.
Мы привели историю создания и сравнение двух разновидностей трансфер факторов – фармпрепаратов и биологически активных пищевых добавок – нутрицевтиков – для того, чтобы показать преемственность, перспективность и безопасность ТФ-нутрицевтиков в программах иммунореабилитации и иммунопрофилактики. Наступил период проведения серьезных клинических контролированных исследований для создания рекомендаций по применению Трансфер Факторов с указанием нозологии, доз, схем и длительности назначения.
Таким образом, использование ТФ открывает новые перспективы модулирования локальных и общих иммунных реакций при пищевой аллергии, атопических кожных реакциях и при заболеваниях, в патогенезе которых ведущее место занимают иммуно-опосредованные механизмы.
2. ПРИМЕНЕНИЕ ТРАНСФЕР ФАКТОРОВ ПРИ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЯХ У ДЕТЕЙ
2.1 Трансфер Факторы в комплексе реабилитационных мероприятий детей, которые часто болеют повторными острыми респираторными заболеваниями
Высокий уровень общей заболеваемости детского населения обусловлен наличием контингента детей, которые повторно болеют острыми респираторными заболеваниями (ОРЗ).
Количество детей этой группы по всем возрастным периодам в 2-2,5 раза больше, чем группы детей, которые болеют реже, и составляет по данным литературы 80-85 %.
К этой группе относятся дети с функциональными отклонениями со стороны различных органов и систем и болеют ОРЗ четыре и больше раз в год, не имеют хронических заболеваний.
Респираторные заболевания особенно характерны для детей, которые посещают детские заведения – школы, садики, что обусловлено особенностями эпидемиологического процесса, распространением контактов ребенка, увеличением психоэмоциональных нагрузок, реакциями стресса, которым принадлежит главное место в адаптации ребенка к новым условиям воспитания. Все это снижает резистентность детского организма и увеличивает риск повторных ОРЗ. Доказано, что 63,0 % данного контингента детей посещают детские учреждения первый год.
Главную роль в формировании группы детей, которые часто и длительно болеют респираторными заболеваниями, играет не только инфекционный агент, но и эндогенные предпосылки – незрелость и неэффективность иммунных механизмов.
На протяжении определенного времени после перенесенного ОРЗ сохраняются основания для повторного заболевания, и это обусловлено снижением иммунных реакций защиты и сенсибилизацией детского организма. Отклонения в иммунной системе организма почти всегда приводят не только к количественным изменениям лимфоцитов, но и нарушают их функциональное состояние. Нарушения клеточного и гуморального иммунитета, которые возникают вначале ОРЗ, стойкие и не приходят в норму с клиническим выздоровлением. А у тех детей, которые повторно болеют, в период между заболеваниями есть выраженные изменения иммунного статуса, которые свидетельствуют о том, что с исчезновением острых явлений заболевания иммунный гомеостаз восстанавливается не сразу. Кроме того, у детей с незрелыми защитно-приспособительными механизмами (со стороны клеточного и/или гуморального иммунитета, а также неспецифических факторов защиты) образуется порочный круг: антигенная стимуляция иммунной системы приводит к напряжению иммунитета, к истощению резервов, потом к развитию вторичных иммунодефицитных состояний, что способствует рецидивированию патологии и повышению заболеваемости детей.
Таким образом, высокий уровень заболеваемости, нарушение иммунитета и аллергизация организма у детей, которые болеют повторными респираторными заболеваниями, обуславливают выделение их в группу диспансерного наблюдения и определяют актуальность вопроса их иммунореабилитации.
Среди большого количества иммунореабилитирующих мероприятий современная фармакологическая иммунокоррекция рассматривается как основной компонент патогенетической терапии рецидивирующих респираторных инфекций у детей. Поэтому иммунокоррегирующую терапию лучше проводить в период ремиссии хронического заболевания, а также у здоровых детей с целью профилактики возникновения хронических заболеваний, что и объединяет понятие иммунореабилитации.
С целью изучения Трансфер Факторов на частоту ОРЗ у детей нами было проведено клиническое и иммунологическое обследование 50 детей в возрасте от 5 до 14 лет, которые часто болели острыми респираторными инфекциями. На первом этапе исследования проведено изучение индивидуальной чувствительности лимфоцитов к ТФ in vitro у 33 часто болеющих детей. Индивидуальная чувствительность иммуноцитов к ТФ in vitro определялась по разработанному Н.Г.Бычковой «Способу определения индивидуальной чувствительности лимфоцитов к иммуномодуляторам» (А.с. №1064952).
Трансфер Фактор классический назначался 30 детям в возрасте от 5 до 14 лет при возникновении ОРЗ и далее прием продолжался в периоде реконвалесценции с целью профилактики дальнейших повторных ОРЗ. В остром периоде дети получали общепринятую терапию (по показаниям антибактериальные, жаропонижающие и антигистаминные препараты, витамины). ТФ назначался детям от 5 до10 лет – по 1 капсуле 2 раза в день, детям старше 10 лет – по 1 капсуле 3 раза в день курсами по 5 дней с пятидневным перерывом между приемами (всего – 4-5 курсов). Контрольную группу составили 20 часто болеющих детей. В нее вошли дети, лечение которых проводилось по вышеуказанной стандартной схеме с использованием растительных адаптогенов, для предупреждения повторных ОРЗ.
Иммунологическое обследование включало: определение содержания сывороточных иммуноглобулинов А, G, M, количества иммунокомпетентных клеток (CD3+, CD4+, CD22+, CD8+, CD16+), изучение функциональной активности лимфоцитов (РБТЛ с ФГА) и активности неспецифических факторов защиты (фагоцитоз) по общепризнанным методикам.
При сопоставлении показателей индивидуальной чувствительности лимфоцитов in vitro с показателями иммунограммы с помощью корреляционного анализа мы выявили следующую закономерность.
Индивидуальная чувствительность лимфоцитов к ТФ статистически достоверно отрицательно коррелировала с относительным количеством CD16+ лимфоцитов (Т-киллеры) в периферической крови. Этот факт может быть одним из дополнительных критериев для использования ТФ. Возможно, повышение чувствительности Т-лимфоцитов к ТФ в определенной мере компенсирует снижение относительного количества клеток-киллеров.
Показаниями к назначению ТФ группе ЧБД была средняя и средне-высокая чувствительность in vitro (25-96%) к ТФ, в результате чего
ТФ был назначен 30 пациентам.
Как показали наши клинические наблюдения под влиянием ТФ у 26 (86,0%) детей основной группы наблюдался выраженный положительный клинический эффект. У пациентов уменьшились симптомы интоксикации, улучшилось общее состояние. ОРЗ протекало без утяжеления состояния. На протяжении первого — третьего месяца наблюдалось уменьшение в объеме небных миндалин. На протяжении 4 — 6 месяцев от начала лечения заболело ОРЗ (легкой или средней степени тяжести, без осложнений) 7 (26,9 %) из 26 наблюдавшихся за вышеуказанный период.
Побочных действий и аллергических реакций при использовании Трансфер Фактора не было.
У детей контрольной группы, которым проводилось общепринятое лечение, непосредственный клинический эффект был аналогичен основной группе. Однако результаты катамнестического наблюдения на протяжении 6 месяцев свидетельствовали о наличии повторных ОРЗ. 13 (65%) детей имели повторные респираторные инфекции верхних дыхательных путей на протяжении 4 – 6 месяцев. У 3 (15%) детей отмечался острый бронхит.
В целом, в динамике наблюдения за ЧБД основной и контрольной группы статистически достоверно реже болели ОРЗ дети основной группы (+/-2=6,66; р(+/-0,01).
В динамике иммунологические исследования проведены у детей основной (n=30) и контрольной (n=20) групп.
До лечения у всех ЧБД наблюдалось умеренное снижение относительного содержания СD3+, СD4+, СD16+ лимфоцитов и тенденция к увеличению СD22+лимфоцитов.
При использовании ТФ отмечена некоторая тенденция к повышению уровня СD3+, СD4+, но данные были не достоверны и не достигали уровня здоровых детей (норма – 54,5±0,6%, 35,1±0,5% соответственно). Однако, статистически достоверным (р<0,05) было увеличение количества СD16+ лимфоцитов в основной группе. У детей контрольной группы их количество повышалось, но не достоверно.
У ЧБД наблюдалось статистически достоверное (р<0,05) снижение по сравнению со здоровыми детьми фагоцитарного индекса нейтрофильных гранулоцитов в периферической крови в обеих группах. Статистически не достоверная была тенденция к снижению показателей РБТЛ с ФГА.
Наблюдалась положительная динамика фагоцитарного индекса у детей основной группы по сравнению с детьми контрольной группы (р< 0,05). Фагоцитарный индекс увеличился в среднем на 8% и превышал показатели у здоровых детей. Такие данные указывают на достаточно активное влияние ТФ на фагоцитоз.
Под влиянием терапии функциональная активность лимфоцитов по данным теста (РБТЛ на ФГА) незначительно повысилась в обеих группах ЧБД. В основной группе средний показатель РБТЛ с ФГА достигал показателей нормы у здоровых детей.
У ЧБД до начала лечения наблюдались изменения в показателях гуморального иммунитета. Достоверно были снижены уровни IgG и IgМ в обеих возрастных группах. Содержание IgA было выше нормы у ЧБД в возрасте до 6 лет и было пониженным у ЧБД старшей возрастной группы.
В группе ЧБД 5-6 летнего возраста, которые получали ТФ, наблюдалось умеренное повышение всех классов иммуноглобулинов, (р<0,05) увеличивалось и превысило норму содержание IgG в сыворотке крови, а у детей старшей возрастной группы отмечалось незначительное увеличение уровня IgG.
Нами дополнительно была оценена частота ОРЗ у 21 ребенка основной группы и 20 детей из контрольной группы на протяжении 10-12 месяцев. 5 детей из основной группы (возраст 3-7 лет), которые заболели ОРЗ повторно на протяжении до 6 месяцев наблюдения, получили повторный курс ТФ по 1 капсуле 2 раза в день. ТФ назначался курсами по 5 дней с пятидневным перерывом между приемами (всего – 4-5 курсов).
Катамнестические данные в течение 10 – 12 месяцев показали, что в основной группе детей, которые получали ТФ, в том числе и повторно, 14 (66,6 %) перешли в группу эпизодически болеющих. В контрольной группе, таких детей было 6 (30 %), что было статистически достоверным (2=7,04; р0,01) реже болели.
При использовании в комплексном лечении часто болеющих детей ТФ наблюдалась положительная динамика в клинической картине заболевания. У пациентов с ОРЗ уменьшались симптомы интоксикации, улучшалось общее состояние, ОРЗ протекало без утяжеления состояния. Клиническая картина также характеризовалась статистически достоверным (2=6,66; р0,01) уменьшением количества детей с повторными ОРЗ за 4-6 месяцев наблюдения. Катамнестические исследования в течение 10 – 12 месяцев показали, что в основной группе 66,6 % детей перешли в группу эпизодически болеющих (2=7,04; р0,01).
Таким образом, Трансфер Фактор классический может быть рекомендован для использования в комплексе лечебно-реабилитационных мероприятий часто болеющим детям с целью профилактики повторных ОРЗ.
2.2. Эффективность применения Трансфер Фактора при рецидивирующем бронхите
Среди контингента детей, которые часто и длительно болеют респираторными заболеваниями, значительную часть составляют дети с рецидивирующим бронхитом).
Несмотря на то, что согласно МКБ Х пересмотра регистрируют только 2 формы бронхита (острый, хронический), в странах СНГ выделение рецидивирующего бронхита как отдельной нозологической формы в детском возрасте является общепризнанным еще с 1981 г.
Анализ факторов риска, способствующих возникновению рецидивирующего бронхита показал, что респираторным вирусам принадлежит ведущая роль в развитии данной патологии. Респираторные вирусы, нарушая барьерные функции слизистой оболочки дыхательных путей, снижают местную и общую иммунологическую резистентность организма и тем самым создают предпосылки для возникновения повторных острых респираторных вирусных инфекций. Кроме того, у детей с РБ к школьному возрасту формируются очаги хронического воспаления ЛОР органов (тонзиллиты, синуситы), что усугубляет состояние местного иммунитета слизистых верхних дыхательных путей и способствует рецидивированию бронхита. Поэтому такие дети нуждаются в наблюдении педиатром и проведении иммуннореабилитации.
Эффективность применения ТФ в комплексе иммунореабилитационных мероприятий у детей с рецидивирующим бронхитом проведено у 80 детей в возрасте 5-14 лет. Обследованную группу составили дети с рецидивирующим бронхитом, которые имели 3-4 рецидива в году с продолжительностью обострения на протяжении 2-3 недель, что соответствовало клиническим критериям заболевания.
Всем наблюдаемым детям наряду с изучением анамнеза заболевания и жизни, данных клинического осмотра проводился комплекс клинико-функциональных исследований, который включал оценку иммунологического статуса, цитоморфологические изменения индуцированной мокроты, исследование функции внешнего дыхания, изучение микробного спектра и вирусологические исследования носовой слизи.
Критериями эффективности проводимых иммунореабилитационных мероприятий у детей с рецидивирующим бронхитом были:
- частота рецидивов бронхита на протяжении года;
- количество случаев острой респираторной инфекции в году;
- динамика показателей цитологического состава индуцированной мокроты;
- динамика показателей иммунологического статуса.
С целью изучения эффективности иммунореабилитации все обследованные дети с рецидивирующим бронхитом методом рандомизации были распределены на 2 группы: основную (40 детей) и контрольную (40 детей).
Всем детям назначался базисный реабилитационный комплекс, который включал диетотерапию, витаминотерапию, закаливающие мероприятия, кинезотерапию, по показаниям – муколитики.
Дети основной группы на фоне базисного комплекса получали Трансфер Фактор Плюс в следующем режиме дозирования: дети от 5 до 7 лет – по 1 капсуле в день, от 7 до 14 лет – по 2 капсулы в день на
протяжении 10 дней , а затем 1 раз в квартал в течении 10 дней.
Трансфер Фактор Плюс наряду с концентратом молозива содержит компоненты, которые повышают его биологические свойства (цинк метионин, смесь Кордиванты, экстракт бобов сои (фито стирола), пищевые
дрожжи).
Результаты мониторингового наблюдения за обследованными детьми с рецидивирующим бронхитом на протяжении 24 месяцев свидетельствовали, что включение ТФ в комплекс иммуно-реабилитационных мероприятий положительно влияло на клиническое течение заболевания.
Так, стойкая клинико–лабораторная ремиссия у детей с рецидивирующим бронхитом достигнута у 94,0 % детей основной группы и у 60,0 % больных контрольной группы. У 90,0 % детей основной группы не отмечались рецидивы бронхита в то время, как у 70,0 % детей контрольной группы, регистрировались 1-2 кратные рецидивы бронхита. Кроме того, у больных основной группы регистрировалась в 2 раза меньше эпизодов острых респираторных заболеваний, чем в группе контроля.
Улучшению клинического течения РБ у детей основной группы соответствовала положительная динамика показателей клеточного состава индуцированной мокроты. Об этом свидетельствовало достоверное
снижение количества эффекторных клеток в индуцированной мокроте по сравнению с контрольной группой (0,9±0,02) 106/л, p<0,05); увеличение количества макрофагов, снижение нейтрофилов и
лимфоцитов, дистрофически изменных клеток реснитчатого эпителия до 60 %. У детей контрольной группы регистрировались стойкие цитоморфологические изменения.
Следует отметить, что у 2/3 детей основной группы и 1/3 детей контрольной группы наблюдалось уменьшение микробной обсемененности слизистой оболочки носа и миндалин и отсутствие инфицированности
респираторными вирусами.
Соответственно улучшению клинического течения рецидивирующего бронхита у обследованных детей основной группы отмечалась положительная динамика в иммунологическом статусе.
В соответствии с полученными результатами иммунологических исследований у детей основной группы достоверно увеличилось количество CD3+ и CD4+ клеток, нормализовался уровень CD19+, иммунорегуляторный индекс, а также отмечена тенденция к нормализации иммуноглобулинов основных классов. Кроме того, отмечена также положительная динамика показателей фагоцитоза: увеличение процента фагоцитирующих клеток до (721,2)%, числа латекс-частичек до (8,20,1)%, снижение спонтанного НСТ-теста до (17,10,15)%, увеличение фагоцитарного резерва до (24,30,5)%.
При анализе динамики уровеней sIgA под действием иммунореабилитации было установлено, что включение Трансфер Фактор Плюс способствовало восстановлению местной противоинфекционной защиты, на что указывало повышение их уровней в слюне (189,489,1) ед/мл и в крови (2,271,39) ед/мл.
Положительная динамика показателей клеточного состава индуцированной мокроты и уровней sIgA может быть объяснена тем, что Трансфер Фактор Плюс улучшает местный иммунитет, в частности, способствует повышению макрофагальных реакций слизистой дыхательных путей.
У детей контрольной группы не определены статистически достоверные различия в динамике изучаемых иммунологических показателей. Полученные данные свидетельствует о иммуномодулирующем эффекте Трансфер Фактор Плюс.
Таким образом, нами установлена эффективность применения Трансфер Фактор Плюс в комплексе иммунореабилитационных мероприятий у детей с рецидивирующим бронхитом. Отмечена хорошая переносимость препарата и отсутствие побочных действий.
Терапевтический эффект Трансфер Фактор Плюс у детей с рецидивирующим бронхитом связан с его иммуномодулирующими свойствами, в частности с влиянием:
- на клеточное и гуморальное звено иммунитета (увеличение количества CD3+, CD4+ клеток, нормализация CD19+ клеток и иммунорегуляторного индекса, нормализация уровней иммуноглобулинов основных классов);
- на показатели неспецифической резистентности (повышение уровней sIgA);
- макрофагальные реакции слизистой дыхательных путей (по данным цитоморфологического исследования индуцированной мокроты).
Трансфер Фактор Плюс может широко использоваться в комплексе иммунореабилитационных мероприятий у детей с рецидивирующим бронхитом и рассматриваться как средство вторичной профилактики при респираторной патологии.
3. ЭФФЕКТИВНОСТЬ ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСЕ ИММУНОРЕАБИЛИТАЦИОННЫХ МЕРОПРИЯТИЙ У ДЕТЕЙ С БРОНХИАЛЬНОЙ АСТМОЙ
Продолжающийся за последние годы рост аллергических болезней у детей ставит проблему аллергической патологии в ряд наиболее важнейших проблем современной медицины. По данным эпидемиологических исследований, проведенных за рубежом и по отделенным назологиям на Украине, данной патологией страдает до 25 % детского населения, при этом наиболее часто регистрируется атопический дерматит, бронхиальная астма, аллергический ринит, крапивница.
Клиническая реализация аллергической патологии осуществляется при участии иммунной системы. При этом, в зависимости от ведущего патогенетического механизма, вовлекаются как факторы врожденного,
так и специфического иммунного ответа.
Известно, что патогенетические механизмы развития аллергии лежат, прежде всего, в нарушении направленности дифференциации
Т-лимфоцитов, снижение активности Т-супрессорных реакций. Поэтому поиск природных средств, регулирующих активность супрессорных клеток, модулирующих локальные и общие иммунные реакции, открывает новые перспективы в иммунореабилитации детей с аллергической патологией.
Проведенные нами исследования у детей с бронхиальной астмой различной степени тяжести показали, что у 2/3 обследованных детей отмечаются разнонаправленные изменения в иммунологическом статусе, среди которых наиболее значимыми были : снижение относительного количества СД3+, СД8+ клеток; повышение СД19+, концентрации IgG и IgЕ при относительном снижении концентрации IgM и показателей местного иммунитета (SgA, лизоцима) в индуцированнной мокроте обследованных детей.
Учитывая иммуномодулирующие свойства Трансфер Фактора, данный препарат был включен в комплекс как специфических (при проведении специфической иммунотерапии (СИТ)) так и неспецифических иммунореабилитационных мероприятий (в эпидемический сезон подъема острых респираторных инфекций) у детей с БА на фоне стандартной базисной терапии.
Под нашим наблюдением находилось 105 детей в возрасте 5-12 лет с бронхиальной астмой различной степени тяжести. Из них 35 детей получали Трансфер Фактор Плюс в комплексе с СИТ (1-я группа) и 40 детей в комплексе противорецидивных мероприятий (2-я группа) на амбулаторно — поликлиническом этапе лечения. Группу контроля составили 30 детей с БА, которые были идентичны по возрасту, полу, тяжести течения заболевания.
ТФ назначался согласно разработанной схеме: детям 5-7 лет – по 1 капсуле 1 раз в сутки, детям 7-15 лет – по 1 капсуле 2 раза в сутки в течение 10 дней с повторними курсами в осенне-зимний период в течение 10 дней (по 2 курса с недельным перерывом).
Критериями эффективности проводимого лечения были : динамика дневных, ночных симптомов (кашля, приступов удушья, затрудненного дыхания), частота обострений, наличие эпизодов ОРИ, показателей функции внешнего дыхания, цитоморфологии индуцированной мокроты и иммунного статуса. Период катамнестического наблюдения составил 12 месяцев. Мониторинг иммунологических показателей проводился через 45 дней от начала лечения и в конце наблюдения.
Проведенные исследования показали, что включение в комплексную терапию ТФ у детей с БА положительно влияет на течение заболевания за счет повышения эффективности медикаментозного лечения (сохранение монотерапии ИГКС у детей 1-й группы и снижение объема медикаментозных препаратов у детей 2-й группы). Это может быть объяснено снижением в 1,6 раз частоты ОРЗ (как триггера обострений) верхних дыхательных путей и более легким их течением.
Соответственно позитивной динамике течения заболевания, что сопровождалось достоверным улучшением функциональных параметров при спирометрическом исследовании (FEV1, FVC, PEF), улучшались показатели цитограммы индуцированной мокроты. На фоне терапии ТФ достоверно снижалось количество эозинофилов, базофилов и повышалось количество макрофагов у детей основной группы (1-й и 2-й) по сравнению с группой контроля (р < 0,05), что отражает уменьшение степени аллергического воспаления и улучшение защитных механизмов респираторного тракта.
Включение ТФ в комплекс иммунореабилитационных мероприятий у обследованных детей сопровождалось также нормализацией иммунного статуса. На фоне проведенной терапии уже через 3 месяца наблюдения имела место нормализация СД3+ (с 49,60+/-1,50 до 56,30+/-1,10 % — в 1-й группе и до 55,70+/-1,00 – во 2 –й группе, р<0,05 по сравнению с нормальными величинами) и CD8+ (с 15,30+/-1,10 по 19,60+/-1,00 % — в 1-й и 18,60+/-1,30 – во 2-й группе, р < 0,05). Кроме того, в группе детей с исходно сниженными показателями местного иммунитета (sIgA, лизоцим) отмечалась их положительная динамика уже через 1,5 месяца от начала наблюдения. В группе контроля регистрировалась только тенденция к улучшению изучаемых параметров. Таким образом, проведенные исследования по изучению эффективности ТФ в комплексной терапии детей с БА показали положительное влияние данного препарата на течение заболевания, активность воспалительных изменений в дыхательных путях, иммунологическую резистентность. Трансфер фактор может бать рекомендован для прменения у детей с БА как иммунонутрицевтик с целью уменьшения аллергического воспаления дыхательных путей и улучшения защиты иммунологических механизмов респираторного тракта.
4. ПРИМЕНЕНИЕ ТРАНСФЕР ФАКТОРА У ДЕТЕЙ С АТОПИЧЕСКИМ ДЕРМАТИТОМ
Одной из актуальных проблем педиатрии является атопический дерматит (АД), поскольку манифестирует в раннем детском возрасте, имеет хроническое течение с частыми обострениями, осложняется вторичной пиогенной инфекцией, сопровождается поражением других органов и систем, что приводит к ранней инвалидизации детей. Под нашим наблюдением находилось 50 детей в возрасте 5-10 годов с атопическим дерматитом легкого и среднетяжелого течения. Все обследованые дети методом рандомизации были разделены на две группы. Основной группе детей (28 пациентов) на фоне базисной терапии, которая отвечала объему лечения согласно протокола предоставления медицинской помощи детям с данной патологией (приказ МОЗ Украины № 767), который предусматривает проведение, прежде всего, диетических мероприятий, назначался ТФ по разработанной схеме.
В период заострения атопического дерматита ТФ применялся следующим образом: детям от 5 до 7 лет — по 1 капсуле 2 раза на сутки, детям от 7 до 15 лет – по 1 капсуле 3 раза на время 3–х кратным курсом в течение 5 суток с 5 суточным перерывом. Повторные курсы проводили ежемесячно длительностью 10 суток (в осенний – зимний – весенний период года): детям 5-7 лет по 1 капсуле 1 раз в сутки, детям 7-15 лет 2 раза на сутки. Контрольная группа, которую составили 22 ребенка соответствующего возраста и тяжести АД, получала лишь базисную терапию.
Критериями эффективности проведенного лечения были: динамика хода заболевания, которая оценивалась по бальной шкале Scorad; частота обострений; динамика показателя колонизации (КОЕ) St. aureus при бактериологическом исследовании соскоба из кожи. Оценка эффективности лечения детей основной и контрольной группы проводилась с помощью интегрального показателя патологии (ИПП). Балльная оценка степени тяжести АД за индексом SCORAD заключалась в оценке степени тяжести АД за тремя направлениями: распространенностью поражений, интенсивностью (выразительностью) поражений и субъективной оценке больным своего состояния. Полученные баллы по каждому из признаков использовали в формуле для подсчета индекса SCORAD. Оценка распространенности поражений на поверхности кожи (%) по правилу девятки (разные отношения частей тела у детей до 2 лет и старше 2 лет и взрослых) представлено в таблице 2:
Таблица 2 — Оценка распространенности поражений на поверхности кожи у детей из АД В процентах
Показатель SCORAD Index высчитывали согласно формуле:
SCORAD Index = А/5 + 7хВ/2 + С, где А – площадь поражения кожи в процентах; В – сумма баллов объективных признаков; С – сумма баллов субъективных признаков.
Критерии определения степени тяжести АД представлены в таблице 3.
Таблица 3 — Критерии оценки степени тяжести АД
В обследуемую группу вошли дети с АД преимущественно легкого течения (18 детей), индекс Scorad которых составил (16,4±7,3) балла и дети со среднетяжелым течением АД (10 детей, индекс Scorad 38,4±2,6). Бактериологические посевы, проведенные с различных участков кожи у 100,0 % детей дали положительный результат. У большинства детей выявлена колонизация кожных покровов патогенными микроорганизмами. St. aureus высевался в 74,6 % случаев, реже — Str.epidermalis у 17,5 % больных и грибы рода Candida 16,2 % случаев.
Проведенные исследования по изучению эффективности применения ТФ в комплексе лечебно — профилактических мероприятий у детей с АД показали положительное влияние данного иммуномодулятора на течение заболевания. Оценивая динамику индекса Scorad было отмечено достоверное его снижение (с 38,4±2,6 до 19,4+7,3 у больных со среднетяжелым течением и с 16,4+7,3 до 10+2,4 у детей с легким течением АД, (р <0,05 по сравнению с группой контроля).
Соответственно положительной динамике течения АД уменьшилась и степень колонизации патогенной микрофлоры у 1/3 больных.
Поэтапное применения ТФ у детей в комплексе иммунореабилитационных мероприятий позволило снизить частоту обострений атопического дерматита в 1,4 раза у детей основной группы. Полученные
результаты исследования документированы проведенными математическими расчетами интегрального показателя патологии (ИПП), который продемонстрировал повышение в 1,3 раза эффективности комплекса
лечения у наблюдаемых детей с включением ТФ по сравнению с базисной терапией.
Таким образом, проведенные исследования обосновывают возможность применения ТФ как иммунонутрицевтика в комплексе диетических мероприятий у детей с атопическим дерматитом, независимо от периода заболевания.
5. ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСНОЙ ТЕРАПИИ У ЖЕНЩИН С ХРОНИЧЕСКИМИ ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ ПОЛОВЫХ ОРГАНОВ
Среди заболеваний, которые нарушают репродуктивную функцию женщин, ведущее место занимают хронические воспалительные заболевания половых органов. В Украине эта патология в структуре гинекологической заболеваемости составляет от 60 до 80 %.
В этиологии этой группы заболеваний характерным признаком микробиоценоза мочевыводящих и половых органов является появление значительного количества новых видов микроорганизмов, большинство из которых могут передаваться половым путем. Среди них наибольшее значение в возникновении хронических воспалительных заболеваний женских половых органов играют хламидии, микоплазмы, уреаплазмы и трихомонады, которые в виде моноинфекции встречаются редко.
Среди микробных ассоциаций наиболее частыми среди женщин с хроническими воспалительными заболеваниями встречаются ассоциации хламидий с трихомонадами (более 30 % случаев), уреаплазмами (более 35 % случаев) и микоплазмами (около 20 % случаев). Часто (более 17% случаев) в состав ассоциаций входит грибковая флора (кандидозная флора) и вирусная инфекция (чаще всего вирус герпеса тип ІІ). Нельзя не обратить особенное внимание на тот факт, что наличие вышеуказанных микроорганизмов и вызываемой ими инфекции обуславливает существенное повышение риска передачи ВИЧ-инфекции.
Проникновению инфекционных агентов способствуют много факторов: прежде всего это снижение барьерных функций организма макрофагальной защиты лизоцима – пептидной системы тромбоцитов и иммунных механизмов (Т-лимфоциты, иммуноглобулины, система комплимента).
Определенную роль в снижении иммунитета может играть наличие очагов инфекции, в частности хронических заболеваний мочевыводящей системы, желчного пузыря и печени, хронического тонзиллита. В таких случаях наблюдается вторичное иммунодефицитное состояние.
Поэтому в комплексной терапии этих заболеваний надо назначать иммунокоррегирующую терапию.
Иммунокоррегирующую терапию целесообразно проводить не только для профилактики возникновения хронических воспалительных заболеваний женских половых органов, но и в процессе их лечения.
Учитывая высокие биологические свойства ТФ и их положительное влияние на иммунный статус, а также отсутствие побочного действие на организм человека, нами проведены клинические исследования по изучению влияния ТФ в комплексе оздоровительно-лечебных мероприятий у женщин с хроническими воспалительными заболеваниями половых органов.
Под нашим наблюдением находилось 100 женщин с хроническими воспалительными заболеваниями половых органов. Все они были распределены на группы по 25 женщин.
Первая группа – женщины с хроническими воспалительными заболеваниями половых органов, которые в комплексной терапии получали Трансфер Фактор (классический).
Вторая группа – женщины с хроническими воспалительными заболеваниями половых органов, которые в комплексной терапии получали препарат Трансфер Фактор Плюс.
Третья группа – женщины с хроническими воспалительными заболеваниями половых органов, которые в комплексной терапии получали препарат Трансфер Фактор Эдвенсд.
Контрольную группу составили женщины с хроническими воспалительными заболеваниями половых органов, которые не получали приведенные иммунонутрицевтики.
В динамике лечения всем обследованным женщинам с хроническими воспалительными заболеваниями половых органов проводили микробиологическое, вирусологическое исследование, ультразвуковую диагностику состояния внутренних половых органов, определялись показатели клеточного и гуморального иммунитета.
Только этапность при лечении женщины с хроническими воспалительными заболеваниями половых органов позволяет провести успешное лечение как воспалительного процесса так и инфекций, которые его вызвали и тех отрицательных последствий в состоянии репродуктивного здоровья и здоровья вообще, которое имеет данная группа женщин фертильного возраста.
В результате проведенных исследований мы рекомендуем придерживаться такой этапности в лечении этой группы заболеваний:
І этап лечения – этиотропная терапия (направленная на микробный фактор), иммуномодулирующая терапия, гипосенсабилизирующая терапия, «местная» терапия;
ІІ этап – назначается в случае выявления вирусной инфекции – противовирусные препараты, иммуностимулирующая и иммуномодулирующая терапия, «местная» терапия;
ІІІ этап – «рассасывающая» терапия, витаминотерапия, иммунокоррегирующая терапия; при необходимости коррекция гормональных нарушений.
Проведенные нами исследования показали, что в микробном спектре микробиоценоза урогенитальных органов больных с хроническими воспалительными заболеваниями половых органов присутствует разнообразная микрофлора, среди которой есть представители патогенетических и условно-патогенетических микроорганизмов, а также инфекции, которые передаются половым путем.
Следует обратить внимание, что в 82 % случаев при определении биотопов организма женщины с этой патологией микроорганизмы встречались в разных ассоциациях. Более частыми среди них были стафилококк эпидермальный, кишечная палочка, грибы вида Кандида (у 45 % случаев); коринебактерии, кишечная палочка, грибы вида Кандида (у 28 % случаев); стафилококк, кишечная палочка, стрептококк (у 12 %); стрептококк, хламидии, грибы вида Кандида (у 10 % случаев).
Полученные результаты микробиологического обследования женщин с хроническими воспалительными заболеваниями половых органов показали, что хламидии являются этиологическим фактором в развитии этой группы заболеваний. Но изолированные в виде моновозбудителей ни у одной из обследованной женщины не определились. Чаще хламидии у женщин с хроническими воспалительными заболеваниями половых органов встречались в ассоциациях. Так частота ассоциаций хламидии – золотистый стафилококк – грибы рода Кандида встречались у 32 % женщин с этой патологией. Объединение хламидий с кишечной палочкой, эпидермальным гемолитическим стафилококком составило 24 %. Часто (22 %) хламидии у обследованных женщин с хроническими воспалительными заболеваниями половых органов встречались в соединении пепто-стрептококками, вирусами полового герпеса, цитомегаловирусом и урео- и микоплазмы.
Данные иммунологического обследования у женщин с хроническими воспалительными заболеваниями половых органов свидетельствуют о том, что у этих больных происходят изменения в состоянии клеточного и гуморального иммунитета, меняется способность лимфоцитов к трансформации в бласты и повышенное состояние рецепторного аппарата Т-лимфоцитов к розеткообразованию. Снижение состояния клеточного иммунитета наряду с изменениями в гуморальном иммунитете, которые проявляются в виде увеличения количества специфических (до определения микробных факторов) иммуноглобулинов G и М.
Особенности изменений в микробиоценозе урогенитальных органов и состоянии клеточного и гуморального иммунитета представлены в табл. 4.
Таблица 4 – Показатели клеточного и гуморального иммунитета у больных с хроническими воспалительными заболеваниями половых органов хламидийной этиологии в динамике
После проведенного комплексного лечения с применением Трансфер Фактор, Трансфер Фактор Плюс и Трансфер Фактор Эдвенсд симптомы хронических воспалительных заболеваний половых органов исчезли у 92 % женщин. У 8 % пролеченных больных сохранялись тазовые боли и нарушение менструальной функции, что потребовало дополнительной коррекции назначения гормональной терапии и терапии, направленной на лечение спаечного процесса органов малого таза.
Микробиологические обследования женщин с хроническими воспалительными заболеваниями половых органов, получавших комплексную терапию: Трансфер Фактор, Трансфер Фактор Плюс и Трансфер Фактор Эдвенсд, показали высокую эффективность в 98 % случаев. В 2 % случаев после проведенного лечения было отмечено слабоположительные результаты, что потребовало дополнительного назначения антибиотикоррекции.
Данные иммунологического исследования, проведенного женщинам всех групп, показали, что у женщин І, ІІ и ІІІ групп (которые использовали в комплексной терапии Трансфер Фактор, Трансфер Фактор Плюс и Трансфер Фактор Эдвенсд) показали улучшение состояния иммунитета, о чем свидетельствовало достоверное уменьшение содержание IgG, IgM (особенно специфических иммуноглобулинов к хламидийной и стафилококковой инфекциям).
Наиболее значимые результаты отмечались в группе больных, которые получали Трансфер Фактор, Трансфер Фактор Плюс и Трансфер Фактор Эдвенсд, что свидетельствует об их большой эффективности.
Проведенные клинические исследования позволяют рекомендовать применение ТФ как нутрицевтиков, которые улучшают функциональное состояние иммунной системы в лечебно-профилактических мероприятиях у женщин с хроническими воспалительными заболеваниями половых органов.
6. СХЕМЫ ПРИМЕНЕНИЯ ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСЕ ИММУНОРЕАБИЛИТАЦИОННЫХ МЕРОПРИЯТИЙ
Комплексная иммунореабилитация должна быть поэтапной и проходить обязательно под контролем иммунологического мониторирования.
При рецидивирующем течении болезни поэтапные иммунореабилитирующие мероприятия являются патогенетически обусловленными и способствуют регрессии основных клинических проявлений заболевания и предотвращающие прогрессирование патологического процесса.
Процесс иммунореабилитации должен включать базисную, восстановительную и поддерживающую иммунореабилитацию.
Базисная иммунореабилитация проводится при обострении хронического или острого протекания заболевания. Этот этап иммунореабилитации продолжается до 30 дней на фоне базисной терапии заболевания после установления степени иммунной патологии.
Восстановительная иммунореабилитация проводится в период реконвалесценции и заключается в проведении восстановительного лечения.
Поддерживающая иммунореабилитация проводится в комплексе противорецидивного лечения в период ремиссии заболевания.
Нами разработаны схемы иммунореабилитационных мероприятий для детей с респираторной патологией, бронхиальной астмой и атопическим дерматитом (табл. 5).
Таблица 5 – СХЕМЫ ПРИМЕНЕНИЯ ТРАНСФЕР ФАКТОРОВ В КОМПЛЕКСЕ ИММУНОРЕАБИЛИТАЦИИ ДЕТЕЙ
СХЕМЫ ЛЕЧЕНИЯ ЖЕНЩИН С ХРОНИЧЕСКИМИ ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ ПОЛОВЫХ ОРГАНОВ
І этап лечения – этиотропная терапия (направленная на микробный фактор), иммуномодулирующая терапия (применение Трансфер Факторов), гипосенсибилизирующая терапия, «местная» терапия;
ІІ этап – назначается в случае выявления вирусной инфекции – противовирусные препараты, иммуностимулирующая и иммуномодулирующая терапия (применение Трансфер Факторов), «местная» терапия;
ІІІ этап – «рассасывающая» терапия, витаминотерапия, иммунокорегирующая терапия (Трансфер Факторы); при необходимости коррекция гормональных нарушений.
ВЫВОДЫ
- Продукты линии 4 Life Трансфер Факторы являются гипоаллергенным иммунонутрицевтиком, полученным из молозива коровьего молока, который содержат цитокиновые фракции, идентичные лейкоцитарным цитокинам. Преимуществом их применения перед известными эндогенными иммуномодуляторами является естественный характер, универсальный механизм действия и отсутствие противопоказаний.
- Клинические исследования свидетельствуют о высокой эффективности трансфер факторов в комплексе иммунореабилитационных мероприятий у детей с респираторной патологией, бронхиальной астмой, атопическим дерматитом.
- Положительное действие Трансфер Факторов как иммунонутрицевтиков связано с их иммуномодулирующим эффектом, в частности влиянием на клеточное звено иммунитета за счет повышения CD3+ и CD8+ клеток и на показатели местного иммунитета (повышение уровня секреторного иммуноглобулина А, лизоцима, количества макрофагов и лимфоцитов в индуцированной мокроте).
- Разработанные схемы поэтапного применения Трансфер Факторов в комплексе лечебных и реабилитационных мероприятий у детей с соматической патологией должны включать базисную, восстановительную, поддерживающую иммунореабилитацию.
- Проведенные клинические исследования позволяют рекомендовать применение Трансфер Факторов как иммунонутрицевтиков, которые улучшают функциональное состояние иммунной системы и повышают эффективность лечебно-профилактических мероприятий у женщин с хроническими воспалительными заболеваниями половых органов.
СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ
1. Бенни Ф. Хроника Трансфер фактора. Факты, научные публикации, отзывы и мнения специалистов, впечатления конкретных пациентов / Ф. Бенни; Перевод Г.П. Стрельниковой. – 36 с.
2. Воробьев А.А. Сборник материалов по результатам клинических апробаций и практического использования нутрицевтиков, содержащих трансфер фактор (TRANSFER FACTOR ТМ) / А.А. Воробьев, М.В.
Кисилевский, Е.О. Халтурина. – 230 с.
3. Дранник Г.Н. In vitro продукция ИЛ-12, 15, 18 клетками больных хронической герпес-вирусной инфекцией под влиянием Трансфер Фактора Эдвенсд / Г.Н. Дранник // В кн.: «Интегративная медицина» /
Материалы международной конференции, 30-31 мая, 2009, г Киев. – с. 135-138.
4. Есенгельдиева А.М. Алиментарная поддержка химиотерапии туберкулеза легких с первичной множественной лекарственной устойчивостью с помощью биологически активной добавки к пище «Трансфер
фактор-плюс»: дис. …канд. мед. наук: 14.00.07 / Есенгельдиева Айгуль Молдабековна. – Алматы., 2010.- 29 с.
5. Иммунореабилитация при инфекционно-воспалительных и соматических заболеваниях с использованием трансфер факторов: Методическое письмо / А.А. Воробьев, Ю.В. Тельных, Е.О.Халтурина и соавт. –
2004. – 35 с.
6. Летифов Г.М. Трансфер фактор – уникальное иммунорегулирующее средство. Опыт применения в медицинской практике. – Барнаул. – 22 с.
7. Лапшин В.Ф. Эффективность применения «Трансфер Фактора Плюс» в иммунореабилитации детей с рецидивирующим бронхитом /В.Ф. Лапшин, Т.Р. Уманец, А.В. Пьянкова // В кн.: «Интегративная медицина» /
Материалы международной конференции, 30-31 мая, 2009, г Киев. – с. 139-144.
8. Хеннен Уильям Дж. Трансфер Фактор Плюс. Идеальная комбинация биологически активных веществ для оптимального иммунитета / Хеннен Уильям Дж.; под ред. Ю.П. Гичева, Э.Огановой [перевод с англ.
Ю.Ю. Гичева]. – Новосибирск. – 2001. – 73 с.
 СЧАСТЬЕ БЫТЬ
ЗДОРОВЫМ
СЧАСТЬЕ БЫТЬ
ЗДОРОВЫМ